
酶制剂在食品工业中应用广泛,其具有绿色环保和可持续发展的特性,然而,苛刻的工业生产条件严重制约着酶在食品工业中的广泛应用。针对天然酶在工业化应用中存在的稳定性差和催化活性低等问题,借助计算机模拟技术改造获得性能优良的酶,是解决该问题的常用策略之一。
为了满足规模化、集约化的食品工业发展需求,研制性能优良的食品工业用酶制剂,对食品工业的快速发展具有重要的意义。酶工程改造中借助计算机模拟技术可以更高效地获得突变体,减少试验工作量和缩短试验周期,极大促进了人们对酶结构与功能构效关系的认识。随着计算机硬件和理论方法的发展,大数据及深度学习、人工智能的方法也开始应用在食品工业用酶改造中。这一数据驱动的技术为蛋白质工程提供了新的开发思路,未来计算机辅助酶设计将向着更加智能和高效的方向发展。
酶是一类具有高效催化活性的蛋白质,催化活性与其三维结构密切相关。高温、高压、高渗透压、极端pH值等食品工业生产环境会破坏酶的三维结构使其失活,从而极大限制了其在食品工业领域中的应用。针对此问题,对食品用酶进行结构改造以提升其催化性能,或者从头设计获得自然界中不存在的酶就变得非常必要。
常用的蛋白质改造方法主要有随机进化、半理性设计和理性设计3种。随机进化是在实验室中模拟自然进化,构建随机突变体文库,通过多轮迭代获得性状改善的突变体,然而突变体文库受库容量及高通量筛选方法限制,有益突变体占比不高。为进一步提升定向进化的效率,(半)理性设计应运而生。该技术基于酶的结构与功能,借助计算机辅助设计方法发现潜在突变位点,设计小而精的突变文库,从而针对性设计和改造蛋白质,是目前研究的热点之一。
食品工业常用酶制剂分类
食品工业用酶制剂作为一种高效、安全、环保的生物催化剂以它独特的优势在食品工业中起着重要作用。酶制剂的使用能够改变食品的形状和质地,增加食品的营养功能,改善食品风味。食品工业酶制剂现已广泛应用于乳制品、食品酿造、肉类、焙烤、饮料、果汁和啤酒等食品工业中。目前食品工业中常用酶的种类超过55种,主要包括:α-淀粉酶、β-葡萄糖苷酶、谷氨酰胺转氨酶、普鲁兰酶、葡萄糖异构化酶、木瓜蛋白酶、葡萄糖氧化酶、脂肪酶等。表1列出了常见的食品工业用酶制剂及其用途。
表1 常见的食品工业用酶制剂及其用途

食品工业用酶设计的分子模拟方法
食品工业生产过程中的极端条件不适合大多数天然酶充分发挥其催化性能。除了定向进化实验技术之外,利用计算机模拟技术理性设计获得在工业环境中性能优良的酶也是常用的方法之一。计算机模拟辅助酶工程改造通过分析蛋白序列、结构与功能之间的关系,预测突变位点,限定突变范围,可显著增加有效突变体的占比,从而大大缩短实验周期,减少实验工作量和节省成本。在食品工业用酶分子设计中常用的计算工具主要有以下5类:同源建模、分子对接、分子动力学模拟、自由能计算和在线网络预测服务。
同源建模
蛋白质的三维结构决定其功能。酶的高效特异催化性能依赖于其错综复杂的三维结构。目前蛋白结构解析主要有X射线晶体衍射、核磁共振及冷冻电镜技术3种试验方法。上述方法存在各自的局限性:X射线晶体衍射必须获得优质的蛋白晶体,然而有些食品用酶不易体外表达或结晶;核磁共振不能解析分子质量大的蛋白质;冷冻电镜价格昂贵、普及率较低。与已测得的庞大数量的蛋白序列相比,目前解析出的蛋白结构非常少。鉴于此,采用计算机模拟技术预测蛋白三维结构就显得尤为重要,而同源建模是目前应用较为广泛的方法之一。依据蛋白序列同源性决定结构同源性的原则,可通过同源性较高且结构已知的蛋白为模板构建目标蛋白的三维结构。构建流程包括:目标序列的搜索、序列比对、模型构建和结构优化与评价。一般而言,目标序列与模板序列的同源性越高,构建的模型越准确。当两者序列同源性小于30%时,得到的目标蛋白结构准确性较差,不建议使用该技术来构建其三维结构。目前同源建模常用的软件有Modeler和SWISS-MODEL等。
分子对接
分子对接是将小分子配基置于蛋白的结合位点处,基于特定的算法搜寻其合理的取向和构象,使得配基与目标蛋白的形状和相互作用都能较好地契合,从而形成互相匹配的结合模式。根据分子对接过程中是否考虑配基和目标蛋白的柔性,可以将分子对接分为3类,即:刚性对接、半柔性对接和柔性对接。刚性对接是指在对接过程中配体和受体都为刚性的,对接过程中构象不发生变化。该方法计算量和计算难度较小,然而,对接的准确性较差。半柔性对接指在对接过程中仅考虑配体的构象变化,受体构象固定不变,其准确度和计算量均适中,因此半柔性分子对接是目前应用较为广泛的方法。柔性对接是指在对接过程中受体和配体的构象均不受限制,可以自由发生变化。与前两种方法相比,该方法准确度更高,然而计算量也大幅增加,只适用于较小的模拟体系。目前常用的分子对接软件为Glide、AutoDock、DOCK和GOLD等。
分子动力学模拟
分子动力学(MD)模拟是基于经典力学和统计力学的理论,根据随机给定的初始位置和势能函数计算出作用在粒子上的力,利用经典的牛顿运动方程,通过数值积分得到下一时刻体系的构象,如此反复,最终获得体系构象随模拟时间的变化轨迹。分子力场是经验势函数,分子力场的参数是根据试验测量值或从头计算拟合得到。目前已开发出针对生物大分子(如蛋白、DNA、RNA及脂质)的全原子力场,小分子力场参数可通过量化计算获得。基于MD模拟计算除了可以获得模拟体系动态的结构信息外,还可获得详细的蛋白-蛋白、蛋白-小分子之间的相互作用。MD模拟流程一般包括:结构转换、溶剂环境的构建(不同pH值、溶剂及模拟温度)、能量最小化、平衡模拟、采样模拟和模拟数据分析。目前MD模拟常用的软件有Amber、Gromacs、CHARMM和NAMD等。
自由能计算
自由能计算方法可定量分析蛋白—蛋白、蛋白—小分子之间的结合作用力。近年来已发展出多种自由能计算方法,包括经典的自由能微扰理论、热力学积分和分子力学-泊松玻尔兹曼表面积自由能计算方法等。自由能微扰和热力学积分的计算结果虽精确,但需要的计算资源较多,且计算时间长。基于MD模拟轨迹,利用MM-PBSA自由能计算方法可以分别获得分子力学作用能、极性溶剂化作用能和非极性溶剂化作用能。由于MM-PBSA计算极性溶剂化作用能时采用隐式溶剂模型,因此兼顾了计算精度和效率,被广泛应用于底物-酶相互作用模式研究。
在线网络预测服务
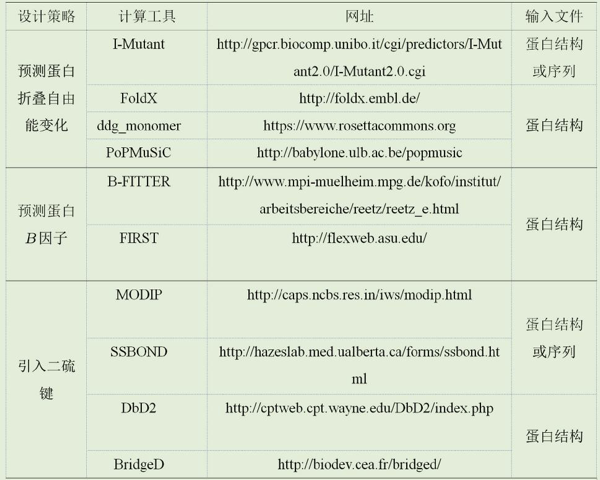
为了方便初学者的使用,研究人员开发出用户友好操作简单的在线网络服务来提高计算机模拟的可及性。突变引起的折叠自由能变化(△△G)与突变体的热稳定性密切相关,△△G小于0表明突变后蛋白质的稳定性得到提升,反之则表明突变会造成蛋白质稳定性的丧失。为了提高在线网络预测的准确度,目前已开发出3种类型的打分函数(即基于机器学习、基于统计和基于力场)来评估突变对酶稳定性的影响。常用的在线网络服务包括:I-Mutant、FoldX、PoPMuSiC和ddg_monomer。
B因子(B-factor)是一个从X射线数据中获得的原子位移参数,反映因热运动而导致的电子密度相对于其平衡位置的振动程度。B因子常用来鉴定蛋白质单个残基的柔性。针对B因子较大的氨基酸进行替换,可降低酶结构柔性,从而提升蛋白质的热稳定性。基于蛋白序列及结构的B因子预测方法主要有B-FITTER和FIRST。
二硫键是蛋白质中相邻两个半胱氨酸侧链巯基脱氢形成的共价键,对维持蛋白质的天然构象和稳定性有重要作用。试验数据表明,每一个天然的二硫键能为蛋白质的稳定性贡献2.3—5.2千卡/摩尔的能量,因此,在合适位置引入二硫键可极大地提升蛋白质热稳定性。常用的在线预测软件有SSBOND、MODIP、DbD2和BridgeD。表2列出了食品工业用酶设计过程中常用的在线网络工具及所需的输入文件。
表2 食品工业用酶设计的在线网络工具
计算机模拟方法在食品工业用酶改造中的应用
现代食品工业中的极端环境往往会破坏天然酶的构象,使其酶活降低甚至完全失活。为了获得性能优良的工业酶制剂,可利用计算机模拟技术进行合理设计。
提升酶的热稳定性
食品工业过程常涉及高温条件操作,因此对工业用酶的耐高温能力有很高的要求。例如,高温普鲁兰酶具有降低糖化溶液黏度和强化传质等优点,然而,目前大多数普鲁兰酶是中温型的,为了提高该酶的耐高温能力,利用在线计算工具预测正向突变点是目前常用的策略之一。Bi等利用I-Mutant/FoldX在线网络工具预测酶的单点突变稳定性,获得芽孢杆菌普鲁兰酶突变体G692M。该突变体在70℃时Tm比野生型升高3.8℃,半衰期延长2.1倍(见表3)。此外,作者还利用MD模拟解析了该突变体热稳定性提高的分子机制:降低区域690—700的RMSF值,增强该区域的刚性,最终提高了该酶的热稳定性。有时单点突变的效果不明显,需要通过多点突变来获得稳定性更高的酶。Chen等综合利用BFITTER/PoPMuSiC计算工具预测潜在突变位点,获得普鲁兰酶多点突变体E518I-S662R-Q706P,该酶的最适温度从60℃提高到65℃,60℃下的Tm升高了9.5℃,半衰期延长11倍。MD模拟分析表明多点突变增加了酶分子内的氢键、疏水和静电相互作用。另外,662位的精氨酸取代也可能对酶热稳定性有所贡献。前期研究表明,精氨酸出现在嗜热蛋白表面的频率较高,这一策略也用于提高淀粉酶和α-L-鼠李糖苷酶的耐热性能。
单一计算策略提升酶稳定性效果有限,多种计算策略联用可大大提高其计算效率。Janssen等开发了FRESCO流程,该流程综合利用计算机模拟软件Rosetta DDG、FoldX和二硫键Dynamic Disulfide Discovery算法预测潜在突变点,然后利用MD模拟去除结构不合理的突变体,最后通过试验验证突变体的耐高温能力。目前已利用FRESCO策略获得了许多耐高温的酶,包括环己酮单加氧酶、脂肪酶、植酸酶和羰基还原酶等。
由于脯氨酸具有特殊的吡咯烷结构,比其他残基具有更少的构象自由度,因此脯氨酸取代也是提升酶热稳定性的常用方法之一。针对脂肪酶热稳定性不高的问题,Zhang等通过试验与计算机模拟结合的方法获得了耐高温酶。整个试验流程如下:(1)同源建模野生型酶的三维结构;(2)野生型酶在不同温度下的MD模拟,以此确定RMSF值较高的氨基酸残基位点,这些位点通常意味着所在区域构象不稳定,对这些位点进行脯氨酸替换可降低主链构象自由度,增加蛋白质稳定性;(3)再次利用MD模拟来筛选热稳定性好的突变体;(4)试验验证突变体的耐高温性能。利用上述试验方法改造获得耐高温的突变体V213P。结果表明,V213P突变体最适温度比野生型高5.0℃,半衰期比野生型延长了70%。
提升酶的酸碱稳定性
极端pH值也是影响酶在工业化应用的关键因素之一。常规α-淀粉酶在低pH值条件下易失活。为了提高其耐酸性,Yang等首先基于枯草芽孢杆菌α-淀粉酶三维结构,选择位于活性位点空腔内的碱性组氨酸His222、His275、His293和His310作为突变点,分别用酸性天冬氨酸替换得到4个单点突变体,其中H222D突变体失活;进一步构建两突变和三突变体,最终获得耐酸性最好的突变体H275D/H293D/H310D,该突变体在pH4.5时Kcat/Km提高16.7倍,保温24h后初始活性保留92%,约为野生型3倍。类似的突变策略用于GH11木聚糖酶,基于氨基酸序列比对的分析结果,将碱性精氨酸、赖氨酸突变为谷氨酰胺和苏氨酸,得到的两株突变体比野生型具有更高的耐酸能力,在pH3的环境下,催化活性分别提高50%和40%。反之,用碱性氨基酸替换酸性氨基酸,可提高酶在碱性环境下的稳定性。例如:增加木聚糖酶中“丝氨酸/苏氨酸表面”的精氨酸数量后,突变体最适pH值比野生型酶最适pH值高。
提升酶的催化活性
利用计算机模拟解析酶的催化机理,进而通过适当增加底物与活性位点之间的亲和力提高酶的催化性能。Chen等结合同源建模和分子对接模拟技术发现I-鼠李糖异构酶的催化口袋中柔性loop环对底物的亲和性影响较大。为了提高其催化活性,将位于loop环上的疏水残基用极性氨基酸替换获得V48N/G59N/I63N和V48N/G59N/I63N/F335S突变体,结果表明:上述两个突变体的催化活性均得到大幅提高。最后,利用MD模拟揭示了催化活性提高的分子机制为两个关键残基突变(V48N和F335S)使得催化口袋收缩,从而增强了酶与底物分子中C6位羟基的相互作用,最终提高了酶对底物的亲和性(见表3)。类似的策略也应用于高效GH10木聚糖酶的改造。
表3 利用计算机辅助技术结构改进食品工业用酶性能应用实例
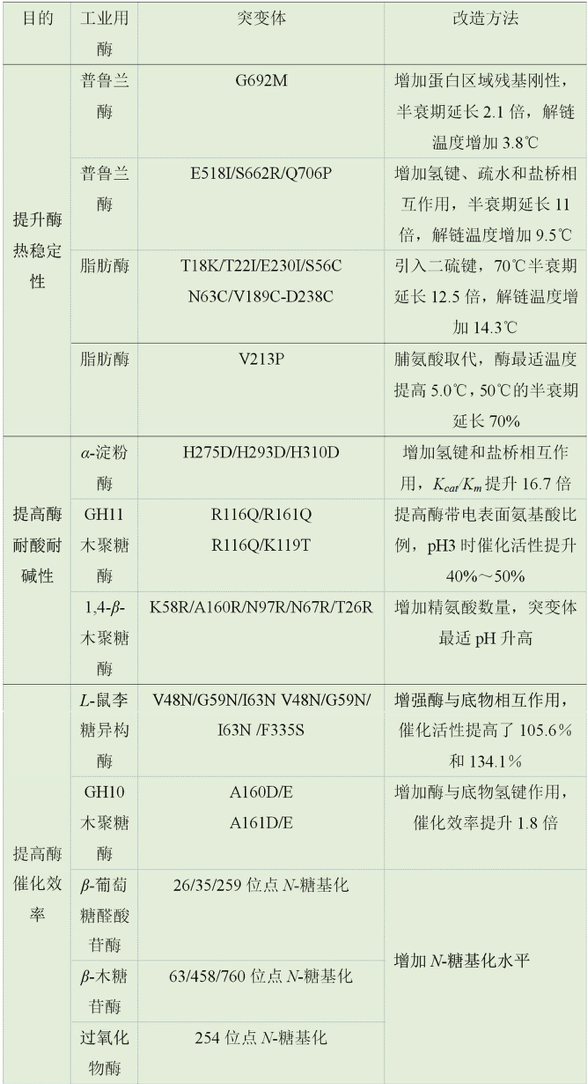
N-糖基化修饰同样也能提升酶的催化性能。N-糖基化修饰位点的选择至关重要。为了选择合适的修饰位点,Wang等基于β-葡萄糖醛酸苷酶的序列和三维结构分析,选取位于loop/turn区域且远离活性中心的糖基化位点,获得3个糖基化的突变体。其中N28位糖基化突变体的Km减小,Kcat/Km增加,表明突变体与底物的亲和力增强,催化效率提升。同样的策略应用到β-木糖苷酶、过氧化物酶中,通过增加N-糖基化位点均成功提高了酶的催化活性(见表3)。
(路福平 黄爱岚 赵蕾 刘晓凤 郭宵 陈宁 刘夫锋)